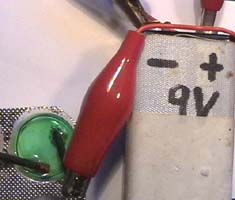 .
. .
.
Abb 4.1 - 4.3
Elektrolyse einer Mischung aus Kupfernitrat- und Kochsalz-Lösung (1 + 2), Chlor-Nachweis (3)
4.Erzwungene Elektronen-Übertragung von Cl- auf Cu2+ ions durch Elektrolyse
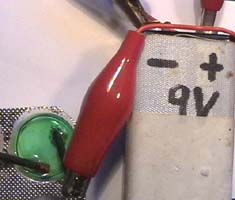 .
. .
.
Die Lösung aus Versuch
1 wird mit einigen Tropfen konzentrierter Kochsalzlösung in ein Blister
gespült. 1 Zwei Bleistift-Minen –verbunden mit einer 9-Volt-Batterie-
tauchen in diese Lösung, so dass kurze Zeit Strom hindurchfließt.
2 An der negativen linken Elektrode tritt Kupfer-farbiger
Belag auf, an der positiven rechten Elektrode erkennt man Gasblasen. 3
zeigt den Nachweis von Chlor um die positive Elektrode: Ein mit farbloser
Kaliumjodid-Lösung getränktes weißes Papier wird braun,
weil Chlor das Jodid zu Jod oxidiert.
Reduktion:
Cu2+(aq) + 2e- --> Cu(s)
Oxidation:
2 Cl-(aq) --> Cl2 (g) + 2e-
Redoxreaktion: Cu2+(aq)
+ 2 Cl-(aq) --> Cu(s) + Cl2
(g)