Microchem
Mikrochemisches
Experimentieren für Lehrer
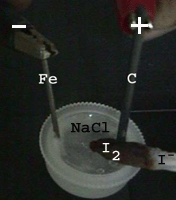 ............
............ ...........
...........
38.
Elektrochemische
Reaktionen von Salzwasser mit einer Anode aus Kohlenstoff:
Ein
früheres
Experiment wird wiederholt. Dabei ersetzt man die Fe-Elektrode durch
eine Bleistift-Mine aus Kohlenstoff (C, Graphit).
Links:
Salzwasser kommt in einen kleinen Plastikdeckel. 4,5 Volt Gleichspannung
liegt zwischen einer Fe-Kathode (-) und einer C-Anode (+). Neben der Anode
befindet sich ein mit Kaliumjodid-Lösung getränktes Papier. Die
Braunfärbung zeigt, dass sich hier Chlor bildete und das Jodid zu
Jod oxidierte.
Mitte:
Hier wird ein mit konzentrierter Ammoniak-Lösung getränktes Stück
Papier zwischen die Elektroden gebracht:
Weißer
Rauch weist Chlorwasserstoff-Gas nach, das mit Ammoniak-Gas zu Ammoniumchlorid
reagierte.
Rechts:
Bei der stärkeren Vergrößerung werden die an beiden Elektroden
Gasblasen gebildeten Gase sichtbar.
Erklärung
der Kathoden-Reaktion: 2 H2O + 2e- -------red---->
2 OH-(aq) + H2 (g)
Erklärung
der Anoden-Reaktion:
2 Cl- ----------ox----> Cl2 (g) + 2e-
Erklärung
der Chlorwasserstoff-Bildung: H2
(g) + Cl2 (g) --> 2 HCl (g)
Copyright:
M.K.El-Marsafy
letzte Veränderung: 18.06.2001
zurück