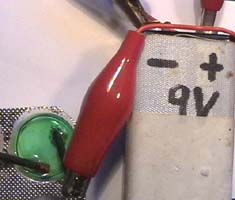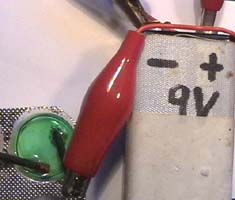


11 Elektrolyse von
Kupferchlorid-Lösung in einem Blister
Beim Testen der elektrischen Leitfähigkeit von Salzwasser (Experiment 4) bildeten
sich Gasblasen (Photo 4). Hier trat unbeabsichtigt eine Elektrolyse auf:
Unter der Einwirkung des elektrischen
Stroms wurde dabei eine
Verbindung zerlegt.
Im
folgenden
Experiment befindet sich eine Lösung in einem Blister
(Sicht-Verpackung
einer
Tablette). Diese Lösung (Elektrolyt) kann -wenn kein
Kupfer(II)chlorid vorhanden ist- ein Gemisch aus Kupfer(II)sulfat und
Kochsalz enthalten oder das Reaktionsprodukt aus
Malachit und Salzsäure. Als Elektroden dienen 2
kurze dicke Bleistift-Minen.
Material
Experimentiertablett, Batterie (9 Volt), 2 Kabel mit
Krokodiklemmen, 2 Bleistift-Minen (D 2 mm HB, L 3 cm), Digitales Multimeter mit Kabeln
für elektrische
Messungen,
Blister,
Gemisch aus Kupfer(II)sulfat
und Kochsalz, dest
Wasser, Kaliumiodid-Lösung, Toilettenpapier.
Aufgaben
1. Elektrolysiere eine
Lösung mit Cu2+- und Cl-
-Ionen zwischen Bleistift-Elektroden
(Photo 1 und 2).
2. Halte an der Stelle der positiven Elektrode einen mit
Kaliumiodid-Lösung getränkten Papier-Docht (Photo 3).
3.
Prüfe
den Geruch an
der Elektrode mit Kupfer-farbenem Belag und
der zweiten Elektrode.
Notiere alle Beobachtungen
(vgl.
mit Photo 1 - 3).
Erklärungen
a) Elektrische
Energie aus der Batterie "pumpt" Elektronen von der positiven zur
negativen Elektrode.
b) positive Kupfer- und negative Chlorid-Ionen (gr. Ionos = wandernd)
bewegen sich zur negatven bzw. positiven Elektrode.
c) An der positiven
Elektrode verlieren Chlorid-Ionen Elektronen. Sie werden zu elementarem
Chlor oxidiert :
2
Cl-(aq) -->
Cl2 (g) + 2e-..
d) An der negativen Elektrode erhalten die Kupfer-Ionen Elektronen. Sie
werden zu elementarem Kupfer reduziert:
Cu2+(aq) + 2e- --> Cu(s).
e) Die erzwungene Redox-Reaktion
von Kupferchlorid zerlegte die Verbindung in ihre Elemente:
)Cu2+(aq)
+ 2 Cl-(aq) --> Cu(s) + Cl2
(g).
f) Das elementare Chlor oxidierte
Iodid-Ionen zu elementarem Iod (Verfärbung des Papiers):
Cl2
(g)
+ 2
I-(aq) --> 2 Cl-(aq) + I2 (s)
zurück.......
weiter.............Veröffentlichung:
16.04.2001....................letzte Veränderung: 11.06.2008