
 ..
.. ..
..
02 Direkte
Elektronenübertragung von Metallen auf Kupfer-Ionen ("Zementation")
Hier sollst Du die chemische Abscheidung
von metallischem Kupfer aus einer Kupfersulfat-Lösung durch
Metalle ("Zementation") kennenlernen.
Dieses Verfahren wird zur Aufbereitung
schwermetallhaltigem Abwasser verwendet.
Bei Kupfergewinnung wird zunächst eine
Kupfer(II)-Salzlösung erzeugt. Im nächsten Schritt fügt
man Schrott zu dieser Lösung.

 Material
Material
Stereolupe, Mikroskop, Objektträger, 3 Ampullen (5 mL,
hoch) in Stativ (= Stopfen einer Infusionsflasche), Schere,
Drähte, (Dosenverschluss, Küchenfolie)
aus Aluminium und aus Kupfer, Nagel, verdünnte
Kupfer(II)sulfat-Lösung.
Aufgabe
1.
Stelle einen Nagel, einen Aluminium-Draht und einen Kupfer-Draht in je
eine Ampulle halb voll mit Kupfer(II)sulfatlösung.
2. Warte, bis die Entfärbung abgeschlossen ist
3. Gib einen Tropfen Kupfer(II)sulfat-Lösung auf einen
Objektträger.
4. Lege ihn unter eine Stereolupe oder unter ein Mikroskop. (Im Videoclip = Alu-Küchenfolie).
3. Schiebe das Aluminium-Stück
von der Seite in den
Tropfen.
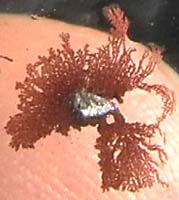
4. Betrachte die Veränderungen unter
einer Stereolupe (Photo 2),
unter der kleinsten Mikroskop-Vergrößerung (Photo 3).
5. Wasche mit etwas Wasser, lasse trocknen, versuche das Metall mit den
Ästchen abzulösen (Photo
4).
Beobachtungen
a)
Kleine
verzweigte kupferfarbene Ästchen wachsen aus dem Metall in
die Flüssigkeit.
b) Gasblasenbildung.
Erklärung
Die Ionen des
edleren Metalls [Cu2+(aq)] entziehen den unedleren
Metallen (z.B Zn, Al, Fe) Elektronen. Dabei werden die Ionen reduziert
und die
Metalle oxidiert.
a)
Reduktion: 3
Cu2+(aq) + 6e- --> 3 Cu(s)
Oxidation:
2 Al(s) --> 2 Al3+(aq)
+ 6e-
Redoxreaktion: 3
Cu2+(aq) + 2 Al(s) --> 3 Cu(s) + 2 Al3+(aq)
Gesamtreaktion: 3 CuSO4 (aq) + 2 Al(s)
--> Al2(SO4)3(aq) + 3 Cu(s)
b) Sowohl Kupfersulfat- als auch Aluminiumsulfat-Lösungen
reagieren sauer. Daher reduziert das Aluminium nicht nur Kupfer-Ionen.
Durch Reduktion von Säure-Wasserstoff ist nach
folgender Reaktion außerdem
die Bildung von Wasserstoff zu erwarten:
Al(s) + 3 H+(aq) --> Al3+(aq) + 3/2 H2 (aq)
Im nächsten Experiment untersuche die
Masseabnahme des unedlen Metalls während der Zementation.
zurück..............weiter.........,,....erste
Veröffentlichung: 21.10.2004 ..................... letzte Veränderung: 12.06.2008
 ..
.. ..
..