In einem früheren Versuch hast Du gelernt, aus unterschiedlichen
Metallen und Orangenhälften eine Galvanische
Zelle und eine Batterie zu bauen. In
den folgenden Versuchen verwendest Du als Elektrolyt anstelle der Fruchtsäuren
die Oberfläche deiner Haut. Dabei vergleichst Du die elektrischen Spannunge,
die zwischen den Metallen Magnesium, Zink, Aluminium (Dosenverschluss einer
Cola-Dose oder blankes Blech einer österreichischen Cola-Dose), Eisen,
Kupfer (Pfennig oder Cent-Münze) und Gold (Ehering oder vergoldeter
Pfennig) auftritt.
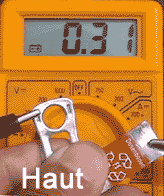 .
. .
.
5. Metalle lassen
sich nach elektrischen Spannungen ordnen
Material
Rechts: Multimeter Voltcraft
VC333, 6 verschiedene Metallproben, 2 Kabel mit Krokodiklemmen.
Aufgaben
1. Presse nacheinander jeweils
zwei unterschiedliche Metalle zwischen Daumen und Zeigefinger.
2. Verbinde die Metalle über
die Kabel mit den negativen und positiven Buchsen eines Messgeräts.
3. Notiere die Spannungen (wenn
ein Minuszeichen auftaucht, tausche die Metalle aus).
Beobachtungen
Links: Zwischen dem
Cola-Dosenverschluss (Al) und dem blanken deutschen Cola-Dosenblech (Fe)
misst man je nach Druck und Hautoberfläche eine Spannung von bis
zu 0,31 V
Mitte: Zwischen einem
blanken Magnesium-Streifen (Mg) und einer Kupfer-Münze gibt es eine
Spannung von 1,32 V.
Rechts: Die
Metalle lassen sich nach steigenden Spannungen folgendermaßen anordnen:
Mg < Zn <Al,< Fe <Cu <Au.
Erklärungen
Hier arbeiten zwei Metalle,
Haut und Messgerät miteinander als Galvanische
Zellen.
Metalle lassen sich nach dem
Kriterium ordnen: "Wer ist der stärkere Elektronendonor,
gibt also die höhere Spannung gegenüber einer positiven Elektrode?"
(Früher hast Du Metalle nach der Stärke ihrer Reaktion mit Säure und mit Wasser geordnet.
Dabei entsteht die Reaktionsreihe: Ca>Mg>Al>Zn>Fe>Cu>Gold
bzw. K>Na>Li.)
zurück....... weiter...........................................................................................letzte Veränderung: 13.09.2004
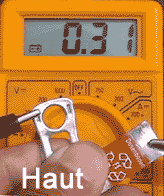 .
.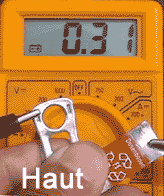 .
.