 1 .
1 . 2..
2.. 3...
3... .4
.4  . 5..
. 5..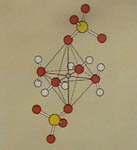 6
6
salz15 Drei
farbige Kupfersalz-Lösungen aus der Malachitspaltung



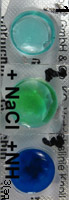
* Photo 1: Im vorigen Experiment
hast Du eine grüne Kupfersalzlösung bei der Reaktion von Salzsäure
mit Malachit erhalten (Photo 1). Hier kannst Du Tropfen davon
in einem Blister weiter verwenden (Photo 2):
* Photo 3: Verdünne
mit destilliertem Wasser.
* Zu der Lösung in
Blister 2 gib Kochsalz (NaCl), zu der im Blister 3 einen Tropfen Ammoniaklösung
(NH3).
* Lasse
die Lösungen eindampfen.
Beobachtung
Photo 3
Wasser-Zugabe bewirkt Blaufärbung.
Photo 4 NaCl-Zugabe
bewirkt Grünfärbung, Ammoniak erzeugt sehr kräftige Blaufärbung.
Photo 5 Nach dem Eintrocknung sieht man
in Blister 1 hellblaue Kristalle, in Blister 2 farblose Würfel und am
Rand einen braunen Feststoffe.
Erklärung
Rechtes Photo: Ähnlich
wie beim Marienglas und beim Kobaltchlorid gibt es
auch bei Kupfer-Salzen Kristallwasser.
In dieser Modell-Skizze
liegt das Kupfer-Ion (kleine graue Kugel) im Inneren einer 8-seitigen Doppelpyramide.
An 4 Seiten ist es von je einem Wasser-Molekül umgeben. Oben
und unten sitzt je ein Sulfat (SO4)-Ion. In wässeriger Lösung
sind auch die Plätze oberhalb und unterhalb jedes Kupfer-Ions (Cu2+)
mit je einem weiteren Wasser-Molekül besetzt. Diese 6 an das zentrale
Kupfer-Ion gebundenen Wasser-Moleküle heißen
Liganden, die farbigen Ionen nennt man Komplex-Ionen.
Photo 4: Die Grünfärbung und
die Blaufärbung sind durch einen Austausch dieser Liganden
zu entstanden:
Wasser-Moleküle werden
durch ein Chlorid-Ion bzw. durch 4 Ammoniak-Moleküle ersetzt.
Photo 5: Beim Eindampfen entsteht in Blister 1 festes Kupferchlorid Cu[H2O)4]Cl2. Die Braunfärbung in Blister
2 erklärt sich durch Ligandenaustausch von Wassermolekülen gegen
Chloridionen.
zurück....... weiter...........erste Veröffentlichung:
18.10.2001................letzte Veränderung: 25.03.2007
 1 .
1 . 2..
2.. 3...
3... .4
.4  . 5..
. 5.. 6
6 1 .
1 . 2..
2.. 3...
3... .4
.4  . 5..
. 5.. 6
6
