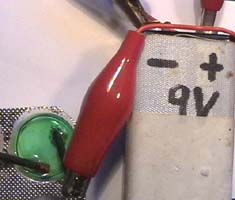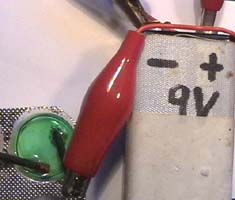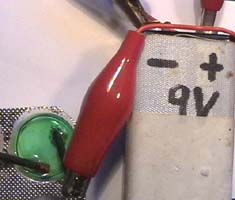

 17 Blister
als
Modell einer wieder aufladbaren Monozelle:
17 Blister
als
Modell einer wieder aufladbaren Monozelle:
Akkumulator (Akku) 1
Eine Monozelle
ist eine zum Betrieb transportabler elektrischer Geräte brauchbare
Galvanische Zelle. Eine wieder aufladbare Monozelle lässt sich nach der
Entladung durch Elektrolyse mit einem Ladegerät wieder verwenden.
Abb. 1 zeigt eine solche Zelle (Nickel-Metallhydrid-Akku Standardformat
"AA").
In einem früheren Experiment (Abb. 2)
wurde durch Elektrolyse von Kupferchloridlösung zwischen
Kohleelektroden eine Kupfer/Chlor-Zelle hergestellt.
Im folgenden Experiment
wird untersucht, ob sich bei dieser Zelle Spannung und Strom messen
lassen. Anschließend wird geprüft, ob sie sich entladen und
durch erneute Elektrolyse wieder aufladen lässt.
Material
Experimentiertablett, Batterie (9 Volt), 2 Kabel mit
Krokodiklemmen, 2 Bleistift-Minen (D 2 mm HB, L 3 cm), Digitales Multimeter mit Kabeln
für elektrische
Messungen,
Blister,
Gemisch aus Kupfer(II)sulfat
und Kochsalz, dest
Wasser.
Aufgaben
1. Wiederhole die Elektrolyse
einer
Lösung mit Cu2+- und Cl-
-Ionen zwischen Bleistift-Elektroden
(Photo 2).
2. Tausche
die Batterie durch ein Multimeter und miss zuerst die Spannung und dann
die
Stromstärke
zwischen den beiden Elektroden (Photo 3 und 4).
4. Prüfe den Geruch an
der Elektrode mit Kupfer-farbenem Belag und
der zweiten Elektrode.
 Vergleiche deine Beobachtungen
mit
denen in den Photo 2
(Elektrolytische Zelle) und denen in Photo 3 und 4
(Spannung [V], Stromstärke [µA].
Vergleiche deine Beobachtungen
mit
denen in den Photo 2
(Elektrolytische Zelle) und denen in Photo 3 und 4
(Spannung [V], Stromstärke [µA].
Erklärungen
Bei dem Blister mit Kohleelektroden und einem Elektrolyten mit Kupfer-
und und Chlorid-Ionen handelt es sich um das Modell eines entladenen
Akkus.
Er lässt sich nämlich durch
Elektrolyse wieder aufladen und liefert beim Entladen Strom.
Die abgelesene Spannung entspricht etwa der theoretisch zu erwarteten
(siehe unten):
....................................Elektrolytische
Zelle...........................................................................Galvanische Zelle
Reduktion:
Cu2+(aq) + 2e- --> Cu(s)................................................Reduktion:
Cl2(g)
+ 2e- --> 2 Cl-(aq)
(U = 1,36 V)
Oxidation:
2 Cl-(aq) -->
Cl2 (g) + 2e-.....................................Oxidation:
Cu(s)
--> Cu2+(aq)
+ 2e-.
(U
= 0,35 V)
Redoxreaktion: Cu2+(aq)
+ 2 Cl-(aq) --> Cu(s) + Cl2
(g)..........................Redoxreaktion: Cu(s) + Cl2
(g) --> Cu2+(aq) + 2 Cl-(aq)
<--- Die freiwillige
Elektronen-Übertragung von elementarem Kupfer auf elementares Chlor
(Visualisierung durch
Perlen-Modelle).
zurück.......
weiter.............Veröffentlichung:
16.04.2001....................letzte Veränderung: 05.06.2008