

 07 Indirekte Elektronenübertragung
von Zink auf Kupfer-Ionen:
07 Indirekte Elektronenübertragung
von Zink auf Kupfer-Ionen:
Galvanische
Zelle 1
Eine
Galvanische
Zelle - benannt
nach Luigi Galvani -
besteht aus zwei verschiedenen
Metallen, die durch eine Salzbrücke
oder durch eine poröse Membran zwischen 2 Halbzellen verbunden
ist.
Im folgenden Versuch
tauchen 2 Halbzellen in eine 1 molare Kaliumchloridlösung.
Die Halbzellen bestehen aus zwei (unten mit einem porösen
Wattestopfen verschlossene) Plastikpipettenspitzen und zwei
verschiedenen Metallen, die von 1 molaren Lösungen ihrer Salze
umgeben sind. Halbzelle 1
enthält einen verzinkten Draht umgeben von 1-molarer
Zinksulfat-Lösung, Halbzelle 2 einen
Kupfer-Draht umgeben von 1-molarer Kupfersulfat-Lösung (Photo 1).
Zur Spannungsmessung sind die beiden Halbzellen
über ein Multimeter leitend verbunden (Photo 2, 3).
Material
Experimentiertablett,
Reaktionsplatte WP6 mit 1 Deckel dazu, 2
Plastik-Pipettenspitzen, Schere, Zange, Nagel (10 cm),
Spiritus-Mikrobrenner, Zinkdraht (verzinkter Blumendraht,
abisolierter Kupferdraht (D
0,8
mm), 2 Einwegspritzen (beschriftet Zn und Cu), 2 Injektionsnadeln (0,8
/ 40 mm), Digitalmultimeter Voltcraft VC333, rote und blaue Kabel mit
Krokodilklemmen, Watte, 1M Lösungen von Kupfer(II)sulfat,
Zinksulfat,
Kaliumchlorid.
Aufgabe
Baue eine Zink-
und eine Kupfer-Halbzelle, verbinde sie über eine Salzbrücke
(IBr) und
über Kabel zu einer
Galvanischen Zelle (Photo 1, 2),
miss die Spannung (Photo 3).
Experiment
1.
Fülle 3 mL 1M Kaliumchlorid-Lösung in eine freie Kammer von
WP6. Verschließe sie mit einem Deckel.
2. Schmilz in größtmöglichem Abstand zueinander mit
einem vorher über dem Brenner erhitzten Nagel 2 Löcher hinein.
Sie müssen groß genug sein, dass sich die
2 Pipettenspitzen bis auf den Boden der Kammer drücken lassen.
3. Verschließe die dünnen Enden der Pipettenspitzen, indem
Du mit einem dünnen Draht je ein winziges
Stückchen Watte hineindrückst.
4. Warte, bis die
KCl-Lösung aus der Kammer hochgesaugt wurde und die Watte damit
bedeckt ist.
5. Fülle die beiden Pipettenspitzen über die Nadeln
Luftblasen-frei mit Zn2+-Salz-Lösung (=
Halbzelle 1) und mit Cu2+-Salz-Lösung
(Halbzelle 2).
6. Tauche die mit dem Messgerät verbundenen Zn- bzw.
Cu-Drähte in die Lösungen ihrer Salze (Photo 1 und 2).
Lies die Spannung ab (Photo 3).
Beobachtung
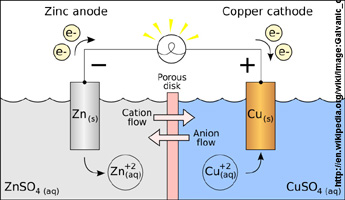
In dieser Galvanischen Zelle wird eine Potentialdifferenz von etwas
weniger als 1,1 V zwischen der Zink-Halbzelle (negative Elektrode)
und der Kupfer-Halbzelle (positive Elektrode) gemessen.
Erklärung
a)
In
der linken Halbzelle gehen an der Grenzschicht Zn/Zn2+ Zink-Atome unter
Zurücklassung ihrer Elektronen in Lösung.
Oxidation:
Zn(s) --> Zn2+(aq)
+ 2e-
Anode (negative
Elektrode der Galvanischen Zelle) ist immer die Grenzschicht zwischen
der Oxidationselektrode und dem umgebenden Elektrolyten (=
Ionen-Lösung.
b) In
der rechten
Halbzelle scheiden sich an der Grenzschicht Cu/Cu2+ Kupfer-Atome (unter
Aufnahme
von Elektronen aus dem metallischen Leiter) ab.
Reduktion:
Cu2+(aq) + 2e- --> Cu(s).
Kathode
(positive
Elektrode der Galvanischen Zelle) ist immer die Grenzschicht zwischen
der Reduktionselektrode und dem umgebenden Elektrolyten.
Ein Fluss von Ionen
erfolgt hier zwischen den in die Kaliumchlorid-Lösung tauchenden
(porösen) Halbzellen.
Die Elektronen fließen im
metallischen Leiter von der Zink- zu
der Kupfer-Halbzelle.
Insgesamt läuft also eine indirekte Redoxreaktion
ab:
Cu2+(aq) + Zn (s)
--> Cu(s) + Zn2+(aq)
Die
Standard-Reduktionspotentiale
der beiden Halbreaktionen Zn --> Zn2+ +
2e- Cu2+ + 2e- --> Cu sind - 0,76 V
und + 0,34 V.
Theoretisch ist unter
den vorliegenden Standardbedingungen eine
Potentialdifferenz von 1,1 V zu erwarten.
zurück....... weiter...........erste Veröffentlichung: 24.01.2005................letzte Veränderung: 27.02.2009


