

08 Indirekte
Elektronenübertragung von Zink auf Kupfer-Ionen 2
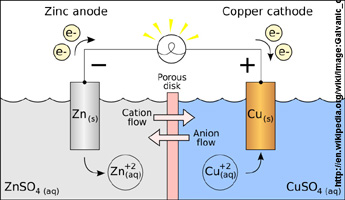
Eine Galvanische Zelle - benannt
nach Luigi Galvani -
besteht aus zwei verschiedenen von Ionenlösungen (Elektrolyten)
umgebenden
Metallen. Diese sind durch einen
metallischen Leiter
verbunden.
Wie im vorigen Versuch steht Zink in
einer Kammer mit 1-molarer
Zinksulfat-Lösung (= Halbzelle 1) und
Kupfer in einer benachbarten Kammer mit 1-molarer
Kupfersulfat-Lösung (= Halbzelle 2).
Zwischen den beiden Halbzellen gibt es neben der metallischen
Verbindung eine Ionenbrücke
(IBr):
Ein Docht aus Toilettenpapier getränkt mit 1M KCl (Photo 2).
 Material
Material
Experimentiertablett,
Reaktionsplatte WP6 Spiralen aus
verzinkter Blumendraht und aus Kupferdraht, Zange, Nagel (10 cm),
Toilettenpapier, Zinkdraht (verzinkter Blumendraht, abisolierter
Kupferdraht (D
0,8
mm), 3 Tropfflaschen, Digitalmultimeter Voltcraft VC333, rote und blaue
Kabel mit
Krokodilklemmen, 1M Lösungen von Kupfer(II)sulfat, Zinksulfat,
Kaliumchlorid.
Aufgabe
Baue eine Zink- und
eine Kupfer-Halbzelle, verbinde sie zu einer
Galvanischen Zellen (Photo 2), miss die Spannungen.
Experiment
1
1. Schneide einen 15
cm isolierten Kupferdraht und 30 cm verzinkten Blumendraht ab. Enferne
die Isolierung, knicke den Blumendraht.
2. Umwickle den Nagel mit dem geknickten Blumendraht und mit dem
Kupferdraht, um Gebilde wie in Photo 1 zu erhalten.
3. Verbinde sie über schwarzes Kabel (Zn) und rotes Kabel (Cu) mit
dem auf 20 V (DC) eingeschalteten Messgerät.
4. Fülle 2 benachbarte Kammern von WP6 mit 1M
Zinksufat-Lösung (links) und mit 1M Kupfersulfat-Lösung.
5. Drehe aus einem halben Stück Toilettenpapier einen Docht,
tränke ihn vollständig mit 1M Kaliumchlorid-Lösung.
6. Tauche ihn als Ionenbrücke (Photo 2: IBr.) mit einem
Ende in die linke Kammer und mit dem anderen in die rechte.
7. Tauche den aufgedrehten verzinkten Draht in die Zink-Salzlösung
und den Kupferdraht in Kupfer-Salzlösung.
8. Lies die Spannung ab (Photo
2).
 Beobachtungen
Beobachtungen
In
dieser Galvanischen Zelle wird eine Potentialdifferenz von etwas
weniger als 1,1 V zwischen der Zink-Halbzelle (negative Elektrode)
und der Kupfer-Halbzelle (positive Elektrode) gemessen.
Erklärung
a)
In
der linken Halbzelle gehen an der Grenzschicht Zn/Zn2+ Zink-Atome unter
Zurücklassung ihrer Elektronen in Lösung.
Oxidation:
Zn(s) --> Zn2+(aq)
+ 2e-
Anode (negative
Elektrode der Galvanischen Zelle) ist immer die Grenzschicht zwischen
der Oxidationselektrode und dem umgebenden Elektrolyten (=
Ionen-Lösung.
b) In
der rechten
Halbzelle scheiden sich an der Grenzschicht Cu/Cu2+ Kupfer-Atome (unter
Aufnahme
von Elektronen aus dem metallischen Leiter) ab.
Reduktion:
Cu2+(aq) + 2e- --> Cu(s).
Kathode
(positive
Elektrode der Galvanischen Zelle) ist immer die Grenzschicht zwischen
der Reduktionselektrode und dem umgebenden Elektrolyten.
Ein Fluss von Ionen
erfolgt hier zwischen den beiden Halbzellen über den mit 1M KCl
getränkten Docht.
Die Elektronen fließen im
metallischen Leiter von der Zink- zu
der Kupfer-Halbzelle.
Insgesamt läuft also eine indirekte Redoxreaktion
ab:
Cu2+(aq) + Zn (s)
--> Cu(s) + Zn2+(aq)
Die
Standard-Reduktionspotentiale
der beiden Halbreaktionen Zn --> Zn2+ +
2e- Cu2+ + 2e- --> Cu sind - 0,76 V
und + 0,34 V.
Theoretisch ist unter
den vorliegenden Standardbedingungen eine
Potentialdifferenz von 1,1 V zu erwarten.
Veränderungen
der Elektroden: Clicke hier
zurück....... weiter...........erste Veröffentlichung: 24.01.2005................letzte Veränderung: 08.06.2008
 Beobachtungen
Beobachtungen