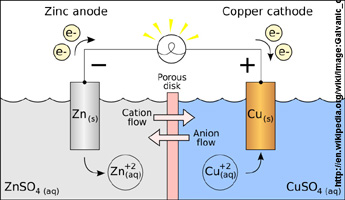
In einer Galvanischen Zelle aus Zink- und Kupfer-Halbzellen sollte die Zink-Elektrode leichter werden, Kupfer-Elektrode schwerer.
Dazu wird der vorige Versuch so wiederholt, dass Zink und Kupfer der beiden Halbzellen direkt durch einen Draht mit Krokodilklemmen verbunden sind.
Zur Untersuchung von Gewichts-Veränderungen werden die beiden Elektroden in trocknem Zustand zu Versuchsbeginn gewogen (Photo 1).
Nach einem Tag spült man die Elektroden ab, trocknet sie und wiegt erneut.
Material
Experimentiertablett, Reaktionsplatte WP6, Digitales Multimeter mit Kabeln für elektrische Messungen, Waage, Nagel (10 cm), Toilettenpapier, Zinkdraht (verzinkter Blumendraht), Zinkblech, abisolierter Kupferdraht (D 0,8 mm), Kabel mit 2 Krokodilklemmen, 1M Lösungen von Kupfer(II)sulfat, Zinksulfat und Kaliumchlorid.
Aufgabe
Baue Zink- und Kupfer-Halbzellen, verbinde sie mit Hilfe einer Salzbrücke und eines Drahts zu einer Galvanischen Zelle (Schema: Photo 2).
Experiment
1. Schneide einen 15 cm isolierten Kupferdraht und 30 cm verzinkten Blumendraht ab. Entferne die Isolierung, knicke den Blumendraht.
2. Umwickle den Nagel mit dem geknickten Blumendraht und mit dem Kupferdraht, um Gebilde wie in Photo 1 zu erhalten.
3. Wiege die Elektroden, und notiere ihre Massen.
4. Verbinde diese Elektroden über ein Kabel miteinander.
5. Fülle eine Kammer von WP6 mit 1M Zinksufat-Lösung (links) und die andere mit 1M Kupfersulfat-Lösung.
6. Drehe aus einem halben Stück Toilettenpapier einen Docht, tränke ihn vollständig mit 1M Kaliumchlorid-Lösung.
7. Tauche ihn mit einem Ende in die linke Kammer und mit dem anderen in die rechte.
8. Stelle den aufgedrehten verzinkten Draht in die Zink-Salzlösung und den Kupferdraht in Kupfer-Salzlösung. Miss die Spannung.
9. Schließe anschließend die beiden Halbzellen über ein Kablel kurz, lasse die Apparatur so lange stehen, bis an der linken Elektrode Rostspuren zu sehen sind (Photo 3).
10. Wiege, ersetze die rostige Elektrode durch ein Stück Zink, wiege die Kupferelektrode nach einigen Tagen erneut (Photo 4).