 .
. .
.
3. Zink und Kupfer in zwei Halbzellen: 1. Potentialdifferenz
Material
Experimentiertablett,
Reaktionsplatte WP6, 1 Deckel dazu, 2 Plastik-Pipettenspitzen,
2 Plastikpipetten, Schere, Zange, Nagel, Spiritus-Mikrobrenner, Toilettenpapier,
Zinkdraht, Kupferdraht, Digitalmultimeter Voltcraft VC333, rote und blaue
Kabel mit Krokodilklemmen, 1M Lösungen von Kupfersulfat, Zinksulfat,
Kaliumchlorid.
Experiment
1. Schneide die Röhrchen
von einem Deckel ab.
2. Schmilz Sie mit einem vorher über dem Brenner erhitzten Nagel
2 Löcher hinein.
Sie müssen groß genug sein, um je eine
Pipettenspitze - wie im linken Photo zu
sehen - aufzunehmen.
3. Verschließe die dünnen Enden der Pipettenspitzen, indem
Du je ein winziges Stückchen
Toilettenpapier hineinschiebst.
4. Fülle 3 mL 1M KCl in Kammer 6, die als Salzbrücke zwischen
den beiden Halbzellen in den Pipettenspitzen dient. Verschließe die
Kammer.
5. Schiebe die Pipettenspitzen so durch den Deckel, dass sie in die KCl
-Lösung tauchen.
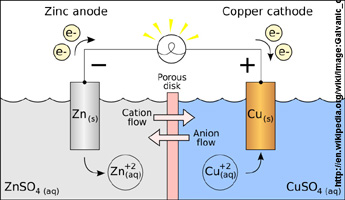
6. Mache aus den Pipettenspitzen eine Zn/Zn2+-Halbzelle und eine Cu/Cu2+-Halbzelle (Photo 1).
Fülle diese dazu mit 1M ZnSO4
bzw. mit 1M CuSO4 und tauche die Drähte aus Zink bzw.
Kupfer ein.
7. Verbinde die beiden Drähte mit einem Multimeter, um die Potentialdifferenz
abzulesen (Photo
2).
Beobachtungen und Erklärung
Es wird eine Potentialdifferenz von 1.06 V zwischen der Zink-Halbzelle
(Anode) und der Kupfer-Halbzelle (Kathode) gemessen.
Die Standard-Reduktionspotentiale der beiden Halbreaktionen Zn --> Zn2+ + 2e-
Cu2+ + 2e- --> Cu sind
- 0.76 V und + 0.34 V, d.h., theoretisch ist eine Potentialdifferenz
von 1.1 V zu erwarten.
Die elektrochemischen Vorgänge sind durch Photo 3 erläutert.