 .
. .
.
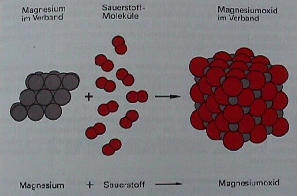
Mol 03 Die kleinsten
Teilchen während des Verbrennens von Magnesium
* Links und Mitte:
Was beim Verbrennen des Magnesiums mit den kleinsten
Teilchen von Mg und O
(Sauerstoff) geschieht,
veranschaulicht die Skizze (Schuphan Knappe,
Chemie Buch Verlag Diesterweg 1988, S. 21).
* Mitte links:
Die Magnesium-Atome im Verband
setzen beim Erhitzen einzelne Mg-Atome
frei.
Mg(s) ----erhitzen----> Mg(g).
(s=solid, fest, g=gasförmig)
* Mitte mitten:
Die Flamme zerlegt Sauerstoff-Moleküle in je zwei Sauerstoff-Atome:
O2(g)---erhitzen---> 2 O(g).
* Mitte rechts:
Bevor Mg-Teilchen und O-Teilchen unter großer Hitze- und Lichtentwicklung
einen neuen
Verband MgO(s)
bilden können, werden aus den Mg- und O-Atomen positive und negative
Ionen.
Atome
(z.B. von Mg und O) sind ungeladen, weil sie positive
und negative Ladungen in gleicher Anzahl besitzen.
Bei ihren chemischen Reaktionen geben z.B. Mg-Atome negative Ladungsträger
= Elektronen ab, andere z.B O-Atome nehmen zusätzlich diese Elektronen
auf. Dabei verwandeln sie sich entweder in positiv geladene Ionen (Mg2+)oder in negativ
geladene (O2-).
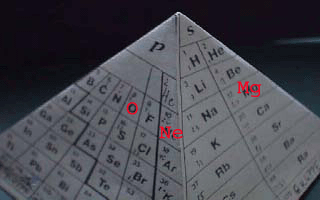
* Rechts:
Magnesium-Atome (12Mg) haben 2 Elektronen
mehr als Atome des Edelgases Neon (10Ne),
Sauerstoff-Atome
(8O) haben 2 Elektronen weniger
als Atome des Edelgases Neon(10Ne).
Zwischen den Mg-
und den O-Atomen findet ein Austausch von Elektronen
statt:
Mg gibt 2 Elektronen
ab, O nimmt diese 2 Elektronen auf, beide werden dabei zu zweifach geladenen
Ionen:
Mg - 2e-
---> Mg2+
O + 2e- ---> O2-
Diese Ionen haben
nun so viele Elektronen wie die Atome des Edelgases Neon (10Ne).
Anders als diese
sind sie extrem reaktiv, ziehen einander an und bilden den MgO-Verband:
Mg2+
+ O2- ---Freisetzung
von Licht und Wärme---> MgO(s)
zurück....... weiter.................................................................................................letzte Veränderung: 07.07.2001
 .
.
 .
.