 .
. .
.
6. Reaktionen zweier Metalle aus einer Cola-Dose mit Säure und Kupfer-Salz
 .
. .
.

 Vorsicht! Salzsäure ist ätzend. Vergiß die Schutzbrille
nicht. Arbeite auf einem Tablett
Vorsicht! Salzsäure ist ätzend. Vergiß die Schutzbrille
nicht. Arbeite auf einem Tablett
Was Du
brauchst: Cola-Dose, Schere, Schmirgelpapier, Blisterpackung Tropfflaschen
mit Salzsäure (10%) und verdünnter Kupfersulfat-Lösung.
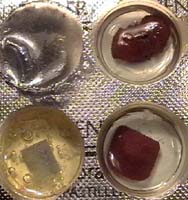
1. Links: Schmirgele
den Verschluss und ein Stück Blech einer Cola-Dose blank.
2. Mitte: In die
zwei linken Blister bringe je 1 mL Salzsäure, in die beiden rechten
je 1 mL Kupfersulfat-Lösung.
3. In die beiden oberen Blister
lege einen Streifen aus dem Verschluss (Al) , in die beiden unteren ein Stück
Blech von der Dose (Fe).
Beobachtungen
rechts: In Salzsäure: Starke Gasblasen beim
Al, schwache beim Fe.
* In blauer Kupfersulfat-Lösung:
Beide Metalle überziehen sich mit einem dicken kupferfarbigen Belag.
* Die blaue Farbe der Lösung
verschwindet bei beiden Metallen.
Erklärungen:
Wie im Experiment mit Zink und Kupfer
finden hier Redoxreaktionen statt:
Die Metall-Atome Aluminium
(Al) und Eisen (Fe) sind Elektronen-Donor,
die Säurewasserstoff-Ionen (H+aq) und blauen Kupfer-Ionen
(Cu2+aq) Elektronen-Akzeptor
in direkten Redox-Reaktionen:
Metallatome
(Me) und die positiven Ionen (I+) berühren einander
während Elektronen (e- ) übergehen.
Die Ionen werden zu Atomen
[dann zu Molekülen von Wasserstoff-Gas (H2g) bzw. zu Kupfer-Metall]
reduziert, die Metalle zu Ionen oxidiert:
2 Al(s) + 6 H+(aq) ---redox---> 2 Al3+(aq) + 3 H2(g) (linke
Blister) Fe(s) + 2 H+(aq) ---redox---> Fe2+(aq) + H2(g)
2 A(s) l + 3 Cu2+(aq) --redox--> 2 Al3+(aq) + 3 Cu(s)
(rechte Blister) Fe(s) + Cu2+(aq) ---redox---> Fe2+(aq) + Cu(s)
Aluminium-Atome geben ihre
Elektronen leichter ab als Eisen-Atome; deshalb reagiert Al in beiden Versuchen
stärker.