01 Direkte
Elektronenübertragung von Magnesium auf
Sauerstoff
Atome reagieren miteinander aus den Bestreben, so viele Elektronen zu besitzen, wie die Atome des im Periodensystem der Elemente am nächsten liegende Edelgas-Atome.
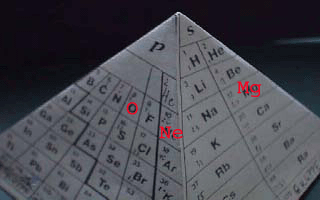
Magnesium-Atome haben 2 Elektronen mehr als Atome des Edelgases Neon, Sauerstoff-Atome haben 2 Elektronen weniger als diese (Photo 3)
Sie tauschen daher diese Elektronen aus. Metall-Atome übertragen dabei Elektronen auf die von Nichtmetallen. Diese werden dabei zu negativen Ionen, jene zu positiven Ionen.
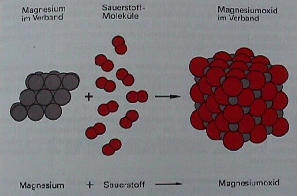
Die Abbildung 2 (Schuphan Knappe, Chemie Buch Verlag Diesterweg 1988, S. 21) zeigt, was mit den kleinsten Teilchen von Mg und O während der Verbrennung des Magnesiums geschieht.
Verwendet man maximal 1 cm Magnesium-Band und arbeitet in einem Experimentiertablett mit etwas Wasser, so scheint seine Verbrennung selbst für den Schülerversuch geeignet: Der Mikro-Spiritusbrenner steht dabei in einem Stopfen als Stativ. Dieser Versuch ist eine gute Übung dazu, dass die heißeste Stelle an der Spitze der Brennerflamme gefunden wird
Material
Experimentiertablett, Schutzbrille, Mikro-Spiritusbrenner, Stopfen einer Infusionsflasche (Stativ), Schere, Pinzette, Schmirgelpapier, Vordruck zur Herstellung einer Periodensystem-Pyramide, Wasser, Brennspiritus, Magnesium-Band (10 x 4 mm).
Aufgabe
1. Der Lehrer verteilt blanke Magnesiumband-Stücke aus.
2. Befestige den Mikrobrenner in einem Stopfen, stelle ihn die Mitte des Experimentiertabletts.
3. Bevor Du ihn anzündest, bedecke den Boden des Tabletts mit etwas Wasser.
4. Fasse das Magnesiumstück an seiner äußersten Ecke.
5. Halte es zum Entzünden in die Spitze der Brennerflamme.
6. Entferne und Lösche den Brenner, sobald die Reaktion beginnt.
7. Stelle eine Periodensystem-Pyramide her.
Beobachtungen
Magnesium (Mg) brennt mit sehr heller Flamme, weißer Rauch steigt auf (Photo 1).
Eine weiße krümelige Masse bleibt zurück.
Erklärung
Aus dem Magnesium und dem Sauerstoff der Luft hat sich in einer stark exothermen Reaktion Magnesiumoxid (MgO) gebildet.
Photo 2 (Schuphan Knappe, Chemie Buch Verlag Diesterweg 1988, S. 21).Was beim Erhitzen mit den kleinsten Teilchen von Mg und O geschieht:
Links: Die Magnesium-Atome im Verband setzen beim Erhitzen einzelne Mg-Atome frei.
Mg(s) ----erhitzen----> Mg(g). (s=solid, fest, g=gasförmig)
Mitte: Die Flamme zerlegt Sauerstoff-Moleküle in je zwei Sauerstoff-Atome:
O2(g)---erhitzen---> 2 O(g).
Rechts: Bevor Mg-Teilchen und O-Teilchen unter großer Hitze- und Lichtentwicklung einen neuen Verband MgO(s) bilden können,
werden aus den Mg- und O-Atomen positive und negative Ionen.
Was dabei zwischen diesen Atomen geschieht, veranschaulicht Photo 3.
Magnesium-Atome (12Mg) haben 2 Elektronen mehr als Atome des Edelgases Neon (10Ne),
Sauerstoff-Atome (8O) haben 2 Elektronen weniger als Atome des Edelgases Neon(10Ne).
Zwischen den Mg- und den O-Atomen findet ein Austausch von Elektronen statt:
Mg gibt 2 Elektronen ab (wird oxidiert), O nimmt diese 2 Elektronen auf (wird reduziert), beide werden dabei zu zweifach geladenen Ionen:
Reduktion: O + 2e- --> O2-
Oxidation: Mg --> Mg2+ + 2e-
Diese Ionen haben nun so viele Elektronen wie die Atome des Edelgases Neon (10Ne), anders als Neon-Atome reagieren sie jedoch miteinander. Sie ziehen einander an und bilden den MgO-Verband
Mg2+ + O2- ---Freisetzung von Licht und Wärme---> MgO(s)
zurück..............weiter.........,,....erste Veröffentlichung: 07.07.2001 ..................... letzte Veränderung: 13.06.2008
Sauerstoff
Atome reagieren miteinander aus den Bestreben, so viele Elektronen zu besitzen, wie die Atome des im Periodensystem der Elemente am nächsten liegende Edelgas-Atome.
Magnesium-Atome haben 2 Elektronen mehr als Atome des Edelgases Neon, Sauerstoff-Atome haben 2 Elektronen weniger als diese (Photo 3)
Sie tauschen daher diese Elektronen aus. Metall-Atome übertragen dabei Elektronen auf die von Nichtmetallen. Diese werden dabei zu negativen Ionen, jene zu positiven Ionen.
Die Abbildung 2 (Schuphan Knappe, Chemie Buch Verlag Diesterweg 1988, S. 21) zeigt, was mit den kleinsten Teilchen von Mg und O während der Verbrennung des Magnesiums geschieht.
Verwendet man maximal 1 cm Magnesium-Band und arbeitet in einem Experimentiertablett mit etwas Wasser, so scheint seine Verbrennung selbst für den Schülerversuch geeignet: Der Mikro-Spiritusbrenner steht dabei in einem Stopfen als Stativ. Dieser Versuch ist eine gute Übung dazu, dass die heißeste Stelle an der Spitze der Brennerflamme gefunden wird
Material
Experimentiertablett, Schutzbrille, Mikro-Spiritusbrenner, Stopfen einer Infusionsflasche (Stativ), Schere, Pinzette, Schmirgelpapier, Vordruck zur Herstellung einer Periodensystem-Pyramide, Wasser, Brennspiritus, Magnesium-Band (10 x 4 mm).
Aufgabe
1. Der Lehrer verteilt blanke Magnesiumband-Stücke aus.
2. Befestige den Mikrobrenner in einem Stopfen, stelle ihn die Mitte des Experimentiertabletts.
3. Bevor Du ihn anzündest, bedecke den Boden des Tabletts mit etwas Wasser.
4. Fasse das Magnesiumstück an seiner äußersten Ecke.
5. Halte es zum Entzünden in die Spitze der Brennerflamme.
6. Entferne und Lösche den Brenner, sobald die Reaktion beginnt.
7. Stelle eine Periodensystem-Pyramide her.
Beobachtungen
Magnesium (Mg) brennt mit sehr heller Flamme, weißer Rauch steigt auf (Photo 1).
Eine weiße krümelige Masse bleibt zurück.
Erklärung
Aus dem Magnesium und dem Sauerstoff der Luft hat sich in einer stark exothermen Reaktion Magnesiumoxid (MgO) gebildet.
Photo 2 (Schuphan Knappe, Chemie Buch Verlag Diesterweg 1988, S. 21).Was beim Erhitzen mit den kleinsten Teilchen von Mg und O geschieht:
Links: Die Magnesium-Atome im Verband setzen beim Erhitzen einzelne Mg-Atome frei.
Mg(s) ----erhitzen----> Mg(g). (s=solid, fest, g=gasförmig)
Mitte: Die Flamme zerlegt Sauerstoff-Moleküle in je zwei Sauerstoff-Atome:
O2(g)---erhitzen---> 2 O(g).
Rechts: Bevor Mg-Teilchen und O-Teilchen unter großer Hitze- und Lichtentwicklung einen neuen Verband MgO(s) bilden können,
werden aus den Mg- und O-Atomen positive und negative Ionen.
Was dabei zwischen diesen Atomen geschieht, veranschaulicht Photo 3.
Magnesium-Atome (12Mg) haben 2 Elektronen mehr als Atome des Edelgases Neon (10Ne),
Sauerstoff-Atome (8O) haben 2 Elektronen weniger als Atome des Edelgases Neon(10Ne).
Zwischen den Mg- und den O-Atomen findet ein Austausch von Elektronen statt:
Mg gibt 2 Elektronen ab (wird oxidiert), O nimmt diese 2 Elektronen auf (wird reduziert), beide werden dabei zu zweifach geladenen Ionen:
Reduktion: O + 2e- --> O2-
Oxidation: Mg --> Mg2+ + 2e-
Diese Ionen haben nun so viele Elektronen wie die Atome des Edelgases Neon (10Ne), anders als Neon-Atome reagieren sie jedoch miteinander. Sie ziehen einander an und bilden den MgO-Verband
Mg2+ + O2- ---Freisetzung von Licht und Wärme---> MgO(s)
zurück..............weiter.........,,....erste Veröffentlichung: 07.07.2001 ..................... letzte Veränderung: 13.06.2008